
Um assistente de laboratório precisou descartar sete frascos contendo solução de nitrato de mercúrio
Um assistente de laboratório precisou descartar sete frascos contendo solução de nitrato de mercúrio
Um assistente de laboratório precisou descartar sete frascos contendo solução de nitrato de mercúrio (I) que não foram utilizados em uma aula prática. Cada frasco continha 5,25 g de Hg2(NO3)2 dissolvidos em água. Temendo a toxidez do mercúrio e sabendo que o Hg2Cl2 tem solubilidade muito baixa, o assistente optou por retirar o mercúrio da solução por precipitação com cloreto de sódio (NaCl), conforme a equação química:
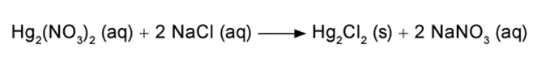
Na dúvida sobre a massa de NaCl a ser utilizada, o assistente aumentou gradativamente a quantidade adicionada em cada frasco, como apresentado no quadro.
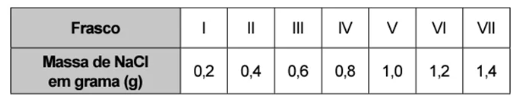
O produto obtido em cada experimento foi filtrado, secado e teve sua massa aferida. O assistente organizou os resultados na forma de um gráfico que correlaciona a massa de NaCl adicionada com a massa de Hg2Cl2 obtida em cada frasco. A massa molar do Hg2(NO3)2 é 525 g mol–1, a do NaCl é 58 g mol–1 e a do Hg2Cl2 é 472 g mol–1.
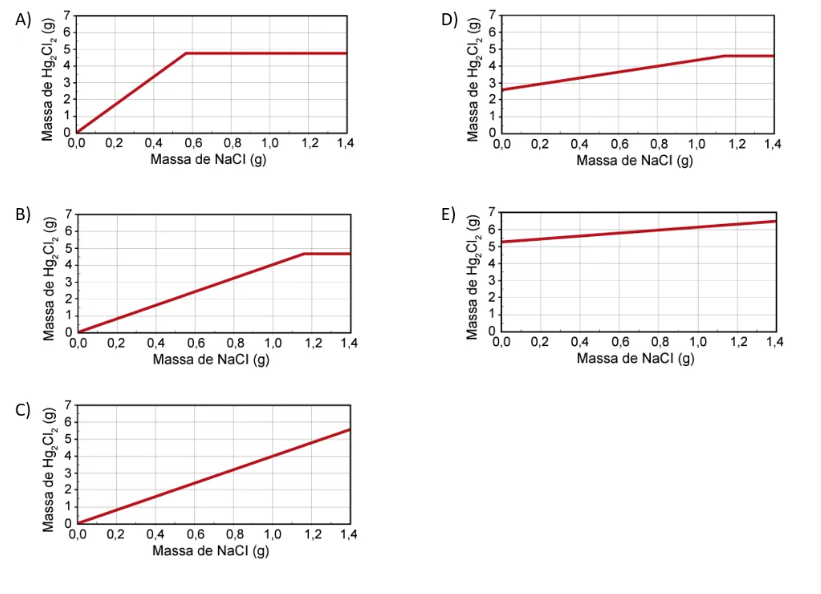
Qual foi o gráfico obtido pelo assistente de laboratório?
Solução
O exercício fornece a massa dos reagentes e também a equação química balanceada. A partir disso é possível calcular qual a quantidade necessária de NaCl para reagir completamente com os 5,25 g de Hg2(NO3)2:
1 mol de Hg2(NO3)2 2 mol de NaCl
525 g ——————————– 116 g
5,25 g ——————————- X
X = 1,16 g de NaCl
O valor de X encontrado é a massa de NaCl que reagirá completamente com os 5,25 g de Hg2(NO3)2. Isso significa que qualquer valor acima de 1,16 g para a massa de NaCl resultará em um excesso do cloreto de sódio (NaCl).
O gráfico obtido pelo assistente do laboratório deve:
– Partir da origem, já que sem massa NaCl não ocorre reação e, portanto, não haverá formação Hg2Cl2
– Ter massa de Hg2Cl2 constante a partir dos frascos VI e VII. Devemos considerar que qualquer valor acima de 1,16 g de NaCl resultará em um excesso do reagente e não haverá mais formação do produto, uma vez que toda a massa de Hg2(NO3)2 terá sido consumida.
Caso seja necessário, também é possível calcular massa máxima de Hg2Cl2 formada:
1 mol de Hg2(NO3)2 1 mol de Hg2Cl2
525 g ——————————– 472 g
5,25 g ——————————- m g
m = 4,72 g de Hg2Cl2 (valor máximo do eixo Y)
A partir do que foi calculado e analisado, o gráfico obtido será o da alternativa B.
Alternativa B


